El Objetivo general de nuestra investigación es entender los mecanismos que intervienen en la regulación de la actividad, la activación y la especificad de acción de la proteina quinasa A en S. cerevisiae. En este organismo existe un gen que codifica para la subunidad regulatoria (BCY1) donde residen los sitios de unión para cAMP, y tres genes (TPK1, TPK2 y TPK3) que codifican para la subunidad catalitica.
En particular nos enfocamos en la regulación por localización de la PKA a través de su subunidad regulatoria BCy1 y de la interacción con proteínas que podrían equivaler a las proteinas de anclaje AKAPs descriptas en mamiferos. Bcy1, al igual que las subunidades regulatorias de PKA de mamiferos, tiene en su extremos amino terminal un dominio denominado D/D (por “dimerization and docking domain”), a través del cual dos monómeros de Bcy1 dimerizan para formar una holoenzima R2C2. En el extremo amino terminal de Bcy1 existen dos regiones ricas en serina denominadas, cluster I y cluster II, cuya fosforilación es determinante para la localización nuclear de Bcy1. A diferencia de mamíferos donde la localizacion de la subunidad R de PKA es mayoritariamente citoplasmática, en levaduras la proteína Bcy1 tiene mayormente localización culear en la fase de crecimiento logarítmico, y se localiza en toda la célula en fase estacionaria.
Experimentos de nuestro laboratorio , en colaboración con el grupo de Silvia Rossi, demuestran que en este extremo amino terminal reside un dominio de interacción con proteínas específicas . Estos resultados indicaron que la naturaleza de la interacción entre estas proteínas y Bcy1 no es de naturaleza hidrfóbica, como ocurre con las AKAPS de mamiferos y las subunidades R correspondientes, sino que es de naturaleza iónica.
Durante la realización de su tesis doctoral Nicolás González Bardeci demostró que en el dominio de dimerización de BCy1 (aa 1-50) reside el sitio de dimerización. Estudios de estructura en solución y cristalización de este dominio, llevaron a la conclusión que el DD puede formar un tetrámero y que la subunidad Bcy1 intacta también. Este resultado es revolucionario pues no se ha demostrado para ningun otro sistema biológico aun.
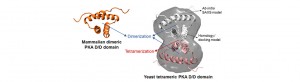
Por experimentos de espectrometría de masa con tecnología Orbitrap hemos demostrado recientemente que el dominio DD puede tetramerizar con el dímero de Bcy1 intacta in vivo. Con la misma tecnología proteómica estamos investigando con que proteinas interactúa este DD de Bcy1 cuando está en su forma tetramérica y cuando está en su forma dimérica, asi como qué importancia tiene en la interacción el estado de fosforilación del cluster de residuos Ser, las proteinas uinass involucradas en esta fosforilación y los efectos en la localización de esta proteína y de la holoenzima.

